FDA批準首個骨髓瘤新靶點藥物Xpovio治療多發性骨髓瘤
Karyopharm Therapeutics是一家以腫瘤學為中心的制藥公司,專注于發現和開發針對核轉運及相關靶標的首創新型療法,用于治療癌癥及其他重大疾病。近日,該公司宣布,美國食品和藥物管理局(FDA)已批準Xpovio(selinexor),聯合地塞米松,用于既往已接受至少4種療法且其疾病對至少2種蛋白酶體抑制劑(PI)、至少2種免疫抑制劑(IMiD)、一種抗CD38單克隆抗體難治的復發難治性多發性骨髓瘤(RRMM)成人患者。

Xpovio是一種核輸出抑制劑,靶向核輸出蛋白XPO1。值得一提的是,該藥是首個也是唯一一個獲FDA批準的核輸出抑制劑,同時是首個也是唯一一個獲FDA批準用于對蛋白酶體抑制劑、免疫調節劑和抗CD38單抗均難治的多發性骨髓瘤(MM)患者的處方藥。此外,Xpovio也是自2015年以來首次針對骨髓瘤新靶點(XPO1)的批準藥物。
Karyopharm公司預計,Xpovio將于7月10日或之前在美國上市。目前,該藥也正在接受歐洲藥品管理局(EMA)的加速審查。在美國和歐盟,Xpovio均被授予了孤兒藥資格,在美國還被授予了快速通道資格。
此次批準基于IIb期STORM研究的緩解率數據加速批準,對該適應癥的持續批準可能取決于確認性試驗中臨床療效的驗證和描述。目前,Karyopharm公司正在開展隨機III期BOSTON研究,評估selinexor與Velcade(bortezomib)及低劑量地塞米松的聯合治療方案,該研究將作為確認性研究。FDA的加速批準項目旨在加速批準治療嚴重疾病及可填補重大未滿足醫療需求的藥物。
STORM是一項國際性、多中心、單組研究,評估了selinexor聯合低劑量地塞米松的療效和安全性。該研究入組了122例既往已接受過三種或多種抗骨髓瘤治療方案(包括烷化劑、糖皮質激素、硼替佐米、卡非佐米、來那度胺、泊馬度胺、抗CD38單抗)并且其骨髓瘤對糖皮質激素、蛋白酶體抑制劑、免疫調節劑、抗CD38蛋白及最后一種療法難治。研究中,患者接受selinexor(80mg,口服,每周2次)聯合低劑量地塞米松(20mg,每周2次)治療,直至疾病進展、死亡或不可接受的毒性。
結果顯示,selinexor聯合低劑量地塞米松方案在一個由83例患者組成的亞組中具有更大的收益風險比,該亞組的總緩解率(ORR)為25.3%,達到首次緩解的中位時間為4周、緩解持續時間為3.8個月。在該亞組中,selinexor具有可預測和可管理的耐受性,安全性與以往研究一致。
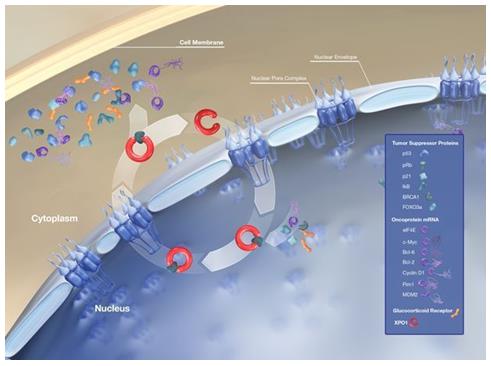
XPO1介導核轉運
selinexor是一種首創、口服、選擇性核輸出抑制劑(SINE)化合物,通過結合并抑制核輸出蛋白XPO1(又名CRM1)發揮作用,導致腫瘤抑制蛋白在細胞核內積累,這將重新啟動并放大它們的腫瘤抑制功能,導致癌細胞選擇性凋亡,同時不會對正常細胞造成顯著影響。
目前,Karyopharm公司也正在多個中期、后期臨床研究中評估selinexor治療一系列血液系統惡性腫瘤和實體瘤的潛力,包括多發性骨髓瘤(3個臨床研究:BOSTON,STORM,STOMP)、彌漫性大B細胞淋巴瘤(SADAL研究)、脂肪肉瘤(SEAL研究)、子宮內膜癌(SIENDO研究)、復發性膠質母細胞瘤(KING研究)。


